在不对称催化反应中,手性分子的形成通常依赖于在立体决定步骤中手性催化剂对产物的手性诱导。也就是说,产物中新产生的手性直接决定于催化剂的作用。然而,在一些情况下,催化剂可能会出现部分或者完全解离的状态,从而导致产物立体选择性控制差或者完全消旋化。因而,确保不对称催化过程中手性的有效传递,是实现高立体选择性反应的关键所在。
金属卡宾反应是最有价值的分子组装方法之一。其不对称转移策略是一种依赖于手性催化剂对产物“点到点”的手性转移方式。例如,金属缔合的两性离子中间体(MZI)通过催化剂的点手性可以实现芳基取代反应中的对映选择性控制(图1a,path a)。但是,在大多数情况下,金属催化剂可能会存在部分或完全解离,形成游离两性离子中间体(FZI)的状态(图1a,path b),从而导致产物立体选择性变差或者完全消旋化。受BINAP和BINOL等联萘衍生物独特轴手性结构的启发,中山大学的徐新芳教授(点击查看介绍)课题组和北京大学的余志祥教授(点击查看介绍)课题组设想,虽然在一般情况下,手性铑(II)催化的金属卡宾反应其立体选择性主要通过金属上的手性配体决定(图1b,左边卡宾结构),并直接导致产物的手性控制效果。但是,当铑(II)催化剂形成带有空间位阻的卡宾中间体时(如邻位取代的芳基卡宾),除了催化剂上的手性以外,该中间体由于碳-碳键的旋转受阻整个分子会产生轴手性(图1b,右边卡宾结构),即存在瞬态轴手性。由于金属卡宾牢固的C=M键,该中间体的轴手性随后通过分子内“轴到点”的手性转移方式最终转移至产物中。因此,在后续的手性传递和立体决定步骤中不再完全依赖于手性金属催化剂的作用,而主要取决于这一瞬态轴手性的控制。
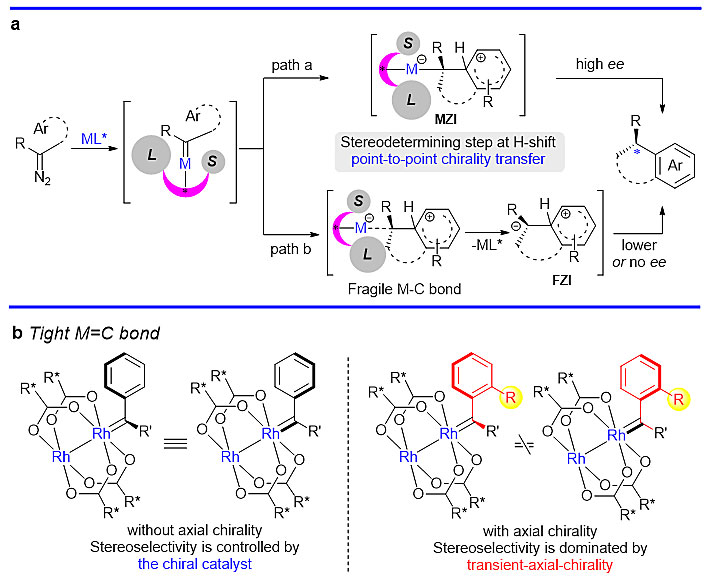
图1. 金属卡宾反应中的不对称诱导及瞬态轴手性铑卡宾中间体设想
近日,徐新芳教授课题组和余志祥教授课题组合作提出了上述的瞬态轴手性控制不对称合成的新概念,报道了金属卡宾通过瞬态轴手性控制的不对称C(sp2)-H官能化构建手性芴的新方法。炔烃键联的重氮化合物在Rh(S-TFPTTL)2催化下形成具有瞬态轴手性的铑卡宾中间体,通过该瞬态轴手性诱导的手性传递策略,简捷、高效地构建具有极高对映选择性的手性9-芳基芴骨架(图2,反应1)。此外,徐新芳教授课题组在前期系统研究的卡宾/炔烃复分解(CAM)串联反应基础上(代表性论文:Org. Lett., 2015, 17, 5638; ACS Catal., 2016, 6, 1024; Adv. Synth. Catal., 2016, 358, 1571; Org. Lett., 2016, 18, 6208; Chem. Commun., 2018, 54, 350; Chem. Eur. J., 2018, 24, 6705; ACS Catal., 2018, 8, 9543; Org. Lett., 2019, 21, 3328; iScience, 2019, 21, 499; 综述论文: Org. Biomol. Chem., 2018, 16, 8677),通过串联双卡宾/炔烃复分解(CAM)过程,进一步推广了这种不对称串联反应的策略,直接构建具有高对映选择性的多环9-芳基芴(图2,反应2)。
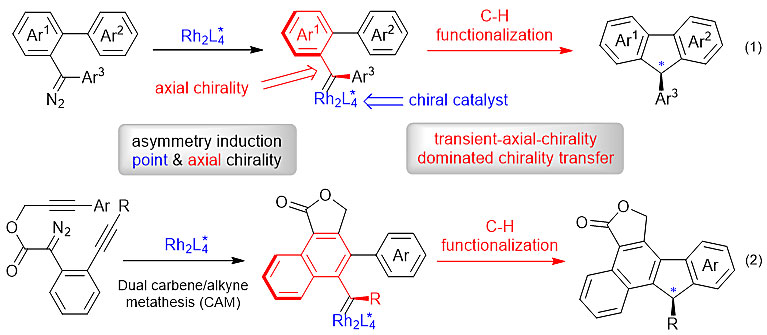
图2. 瞬态轴手性控制不对称C(sp2)-H官能团化反应
在优化条件下,作者对底物范围进行了考察(图3,图4)。缺电子和电中性芳基均能较好地反应;简捷、高效地构建具有极高对映选择性的手性(多环)9-芳基芴骨架。
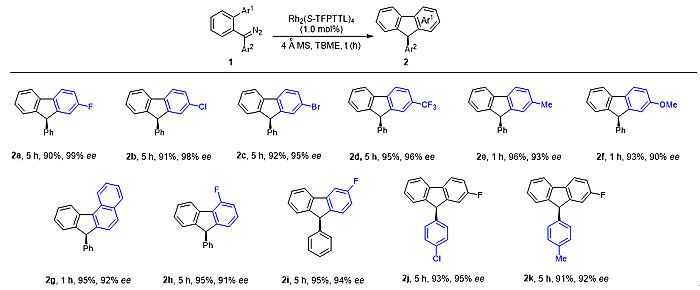
图3. 直接不对称C(sp2)-H官能团化反应构建9-芳基芴骨架
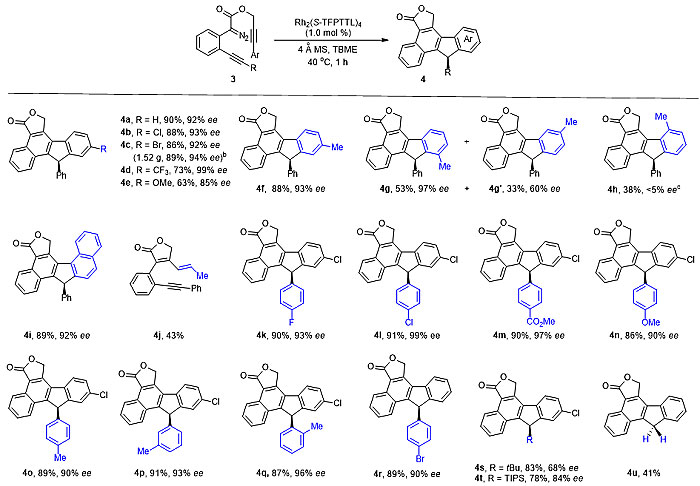
图4. 卡宾炔烃复分解串联反应构建多环9-芳基芴骨架
为了支持关于瞬态轴手性策略的假设,余志祥教授课题组对反应1进行了DFT计算(图5)。考虑到轴手性中心应该是在铑卡宾的生成过程(即重氮化合物的分解过程)中形成的,作者对此步的对映选择性进行了详细的计算。计算结果表明,Rh(S-TFPTTL)2提供了螺旋手性环境,根据底物的两种不同的构象他们成功优化并得出了一组生成相反轴手性中心的过渡态。DFT计算结果表明,S构型的形成是更具优势的,在TS-S的结构中,可以明显观察到底物与手性配体之间的π-π堆积相互作用。考虑到重氮的分解是不可逆的,且非扩散控制的过程,该反应将有利于通过TS-S的S途径生成手性铑(II)卡宾中间体IN-S,其因C-C键的旋转受阻而具有短暂的轴手性且无法转化为IN-S,生成的轴手性将通过C–H插入反应最终传递到产物中。

图5. 直接不对称C(sp2)-H官能团化反应的DFT计算
同时对反应2关键的卡宾/炔烃复分解步骤进行了DFT计算(图6)。计算结果表明,整个反应是一个大放热的过程,每个步骤都很容易。最终的C–H插入可被视为整个催化过程的速率决定步骤。DFT计算势能面提供了当前串联反应的完整过程。该机理也被用来解释为什么底物3h具有较低的反应性,同样重要的是,通过ISC过程的发现对于卡宾-Rh-二聚体复合物的在将来对类似过程的理解具有重要意义。
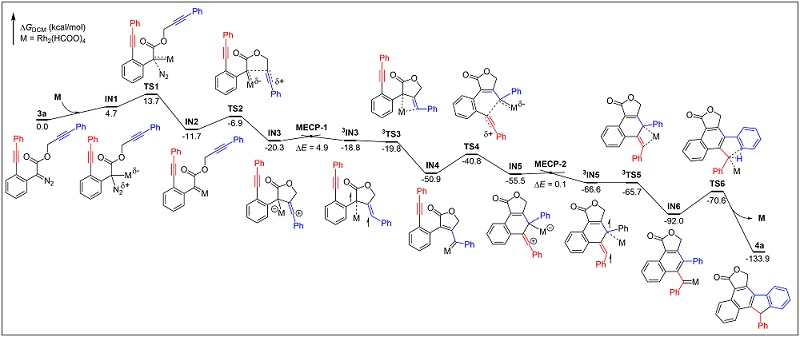
图6. 双卡宾/炔烃复分解(CAM)过程不对称C(sp2)-H官能团化反应的DFT计算
然后根据上述机理的见解,作者研究了真实系统的对映选择性。在与重氮底物形成配合物后,获得了具有不同取向的两个可能的过渡态(图7)。研究发现,在优势的构象中(即pro-S TS),苯炔丙基对配体的空间排斥性较小,同时苯炔丙基与配体芳环之间也存在较弱的π-π堆积相互作用,生成的轴手性铑卡宾中间体经两次CAM过程后最终经C-H键插入反应得到产物。
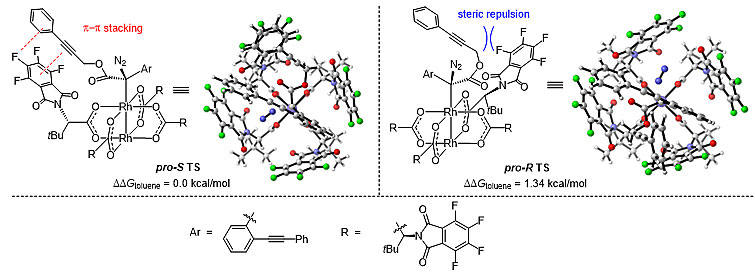
图7. 反应2对映选择性控制过渡态

图8. 轴手性中间体转vs C-H键插入反应
此外,为了证明此反应的对映选择性控制步并非C-H键插入步骤,作者对C-H键插入前的轴手性中间体间的相互转化过程进行了计算,计算结果表明两种轴手性中间体转化的能垒远高于直接发生C-H键插入反应(图8),因此产物的对映选择性将完全来自于轴手性的生成步骤。
总结
徐新芳和余志祥教授课题组首次提出并通过计算证实了金属卡宾不对称催化反应中的瞬态轴手性传递新方法(图9)。该研究通过金属卡宾牢固C=M键的特点,揭示了瞬态轴手性铑卡宾中间体的存在。这一中间体的轴手性可以有效确保随后手性传递和最后C(sp2)-H插入反应中的高立体选择性。DFT计算显示出了π-π堆积作用为主的手性识别模式和独特的“轴对点”的手性传递过程。同时对两个反应的反应机理进行了详细的机理研究,发现CAM反应中的系间窜越(ISC)现象。该研究工作受到国家自然科学基金委(“多层次手性物质的精准构筑”重大研究计划91856105;21971262)、广东省手性分子与药物发现重点实验室、广东省珠江人才计划引进创新创业团队(2016ZT06Y337)的支持。这一成果最近发表在Nature Communications 上,董奎勇和樊星为文章共同第一作者。

图9. 瞬态轴手性控制不对称合成
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Transient-axial-chirality controlled asymmetric rhodium-carbene C(sp2)-H functionalization for the synthesis of chiral fluorenes
Kuiyong Dong, Xing Fan, Chao Pei, Yang Zheng, Sailan Chang, Ju Cai, Lihua Qiu, Zhi-Xiang Yu, Xinfang Xu
Nat. Commun., 2020, 11, 2363, DOI: 10.1038/s41467-020-16098-8
徐新芳教授简介
徐新芳,中山大学药学院教授,先后在华东师范大学获得学士学位(2001)和博士学位(2010,导师:胡文浩教授),随后在美国马里兰大学Michael P. Doyle 教授课题组从事博士后研究(2010-2014);之后于2014年9月回国加入苏州大学材化部任教授,现为中山大学药学院教授;研究方向主要包括不对称催化、卡宾/炔烃复分解反应、金属卡宾参与的串联反应和多组分反应、手性药物合成等,至今已在Acc. Chem. Res., J. Am. Chem. Soc., Angew. Chem. Int. Ed., CCS Chem., ACS Catal., Chem. Sci. 和 Org. Lett. 等期刊发表论文90余篇,引用1200余次。
https://www.x-mol.com/university/faculty/49985
余志祥教授简介
余志祥,北京大学化学院教授。1987-1991,武汉大学,学士;1994-1997,北京大学,硕士;1997-2001,香港科技大学,博士;2001-2004,加州大学洛杉矶分校,博 士后;2004-2008,北京大学,副教授,博导,理论和合成有机化学学术带头人,独立课题研究组组长;2008-现在,北京大学,教授,博导,理论和合成有机化学学术带头人。
余志祥教授主要从事于将理论计算和有机合成相结合来研究有机化学反应机理,发展有机合成方法,并将发展的有机合成方法应用于天然产物与药物分子的合成。目前已对 Lu-[3+2]环加成反应、金属催化环加成反应、卡宾的插入反应等十几种重要化学反应的机理进行研究;从理论和实验上发现和验证了[1,2]-质子迁移过程需要水和其它质子给体作为催化剂的重要现象;提出一种新的半定量的前线分子轨道方法来半定量地计算反应的活化能以及分子的亲核性和亲电性;发展了合成不同环系的[3+2]、[5+1]、[3+2+1]、[4+2+1]、[7+1]、[5+2+1]等成环反应并将其中的一些反应用于多个天然产物的合成。
余志祥教授近年获得的主要荣誉有:1. 药明康德生命化学研究奖-学者奖,2018;2. 北京大学拜尔研究者奖,2018;3. 教育部长江学者,2015;4. 全国百篇优秀博士论文指导导师,2012;5. 中国化学会-Sci-Finder有机合成创造奖,2011;6. 中国化学会-巴斯夫公司青年知识创新奖,2011;7. 中国化学会-物理有机化学奖,2011;8. 国家杰出青年基金获得者,2008。
https://www.x-mol.com/university/faculty/8608
 实验外包
实验外包
 方案定制
方案定制
 仪器预约
仪器预约
 技术研发
技术研发
