羟腈裂解酶广泛分布于自然界,是植物通过氰醇裂解产生氢氰酸以抵御天敌的重要防御机制。在有机合成领域,不对称羟氰化是最早应用的酶反应,也是构建邻位手性C–N/C–O或C–O/C–O砌块最为重要的方法之一。然而,绝大多数天然的羟腈裂解酶仅能转化简单的芳香或脂肪醛,对于结构庞大而复杂的醛类底物,则倍显无力。
以抗哮喘药物β2-受体激动剂为例,尽管早在1997年德国科学家即利用羟腈裂解酶催化苯并[1,3][d]二噁烷环类甲醛 (1b–1c) 的羟氰化 (J. Org. Chem., 1997, 62, 3867–3873),但由于后续的缩醛保护基脱除步骤造成产物苄位羟基的消旋化而导致该路线无法在工业上应用。虽然使用较易脱除的缩酮保护基 (1d) 可以有效地抑制产物的消旋化,但令人遗憾的是二十多年来,迄今尚未报道任何可催化该类大位阻药用底物 (1d) 有效羟腈化的新酶。

图1. 基于酶促羟氰化反应合成典型β2-受体激动剂存在的挑战
近期,华东理工大学许建和团队联合中科院上海有机所洪然、林国强团队,通过蛋白质工程方法,理性设计羟腈裂解酶,成功打通这一多年受挫的酶-化学级联合成路线。研究者首先解析了前期获得的巴达木羟腈裂解酶PcHNL5及其与天然底物苯甲醛 (1a) 的复合物晶体结构,基于苯并[1,3][d]二噁烷环相较于苯甲醛的苯环衍生位置,成功鉴别到位于底物通道上的关键残基Leu331,仅凭单位点的突变,便使PcHNL5对目标底物1d的羟腈化活力提高590倍。

图2. 羟腈裂解酶的理性重设计。A) PcHNL5与苯甲醛(1a)的复合物晶体结构;B)影响PcHNL5与底物1d结合的关键位点;C)突变体L331A与野生酶对苯并[1,3][d]二噁烷环类芳基甲醛的比活力。D)突变体L331A和野生酶所催化的底物1d羟氰化反应对比。
研究者通过酶突变体的晶体结构解析和表观动力学研究,发现Leu331位于酶的底物通道上,其侧链残基的形状或大小可能调控PcHNL5的底物适应性。活力测定结果表明,331位氨基酸的侧链变化可调节苯甲醛类衍生物在苯环3,4-位的空间位阻敏感性,而其对底物极性的变化不太敏感。通过构建小而巧的突变体库,将Leu突变为不同的氨基酸 (Trp、Phe、Val、Ala、Gly),就能实现一系列结构各异的复杂芳香醛的酶促羟腈化,转化效率提升最高达293倍,使得酶促反应的速率远远超过自发羟腈化的速率,从而保证了产物氰醇的高光学纯度。特别值得一提的是,由于PcHNL5通过毕赤酵母实现高效的胞外分泌表达,发酵上清液只需经过简单的酸化 (pH~3.5),即可直接用于羟氰化反应,非常更适合大规模工业应用中的成本控制要求。在两相酶促反应体系中,β1-受体阻断剂、镇静剂、β1-受体激动剂及ACE抑制剂等一系列药物活性分子的前体氰醇得以高效酶促合成。其中,研究者利用突变酶L331A成功开发了首条β2-受体激动剂(R)-salmeterol的化学-酶法合成路线,从简单的醛1d出发完成酶促羟氰化后,经氢化铝锂还原和溴代物5的N-烷基化,最终在醋酸/水中脱除丙酮叉保护基,以54%的总收率完成了光学纯(R)-salmeterol的克级制备。这也彰显出化学家基于结构分析所理性设计的酶突变体库在构建高效绿色合成途径中的巨大潜力。
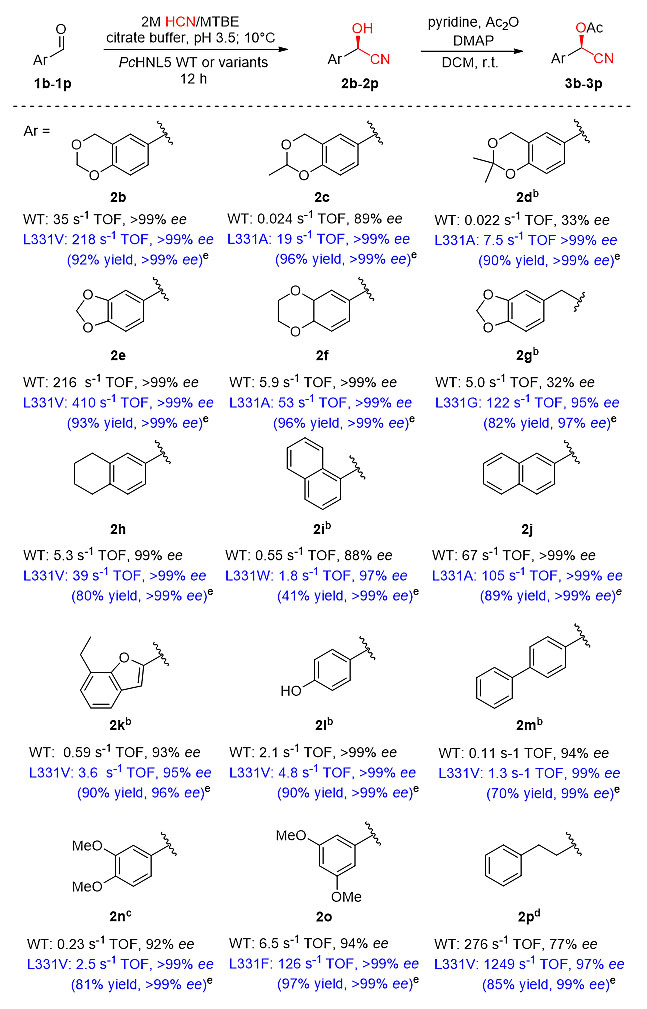
图3. 利用PcHNL5L331突变体,β1-受体阻断剂、镇静剂、β1-受体激动剂及ACE抑制剂等一系列药物活性分子前体氰醇得以高效转化

图4. 化学酶法制备β2-受体激动剂(R)-沙美特罗
该论文近期发表于ACS Catalysis,通讯作者为华东理工大学许建和及郁惠蕾教授和中国科学院上海有机化学研究所洪然研究员。第一作者为华东理工大学博士研究生郑宇璁。该工作得到国家自然科学基金、国家重点研发计划和中科院先导项目的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Structure-Guided Tuning of a Hydroxynitrile Lyase to Accept Rigid Pharmaco Aldehydes
Yu-Cong Zheng, Fu-Long Li, Zuming Lin, Guo-Qiang Lin, Ran Hong*, Hui-Lei Yu*, Jian-He Xu*
ACS Catal., 2020, 10, 5757−5763, DOI: 10.1021/acscatal.0c01103
许建和教授课题组简介
许建和,华东理工大学教授,博士生导师。本科毕业于清华大学化学系,华东理工大学与京都大学联合培养博士。1995年起历任华东理工大学助研、副研、教授。教育部长江学者特聘教授(2009-2011)。曾任生物反应器工程国家重点实验室主任(2006-2017),并获评优秀,现任上海生物制造产业技术协同创新中心主任和国际期刊Bioresources and Bioprocessing主编。荣获全国优秀教师、上海市科技领军人才、谈家桢生命科学创新奖、中国酶工程杰出贡献奖等荣誉。课题组依托生物反应器工程国家重点实验室,主要针对合成生物学和合成化学对催化元件的迫切需求,采用序列筛选、定向进化、理性设计及机器学习等多种方法,构建新颖高效的多酶催化系统,研究揭示酶的构效关系及其调控规律,并致力推进酶在合成产业的实际应用。近五年来主持承担包括国家重大研发计划(合成生物学项目主持:新分子生化反应的设计与生物合成系统构建)和国家自然科学基金重点基金在内的研究课题20余项,在Proc Natl Acad Sci, Angew Chem, ACS Catal 等期刊发表SCI论文320篇,授权中国发明专利60项、美国发明专利1项,获得2018年上海市技术发明一等奖。
课题组现诚聘2–3名博士后,招聘详情请见:
http://personnel.ecust.edu.cn/2020/0109/c7474a103972/page.html
课题组网址:
http://sklbe.ecust.edu.cn/biocatalysislab/CN/Default.aspx
https://www.x-mol.com/university/faculty/78665
 实验外包
实验外包
 方案定制
方案定制
 仪器预约
仪器预约
 技术研发
技术研发
